2017年,有关最新不合格药品的消息引起了广泛关注,这被视为质量监管领域的一次警钟。这些不合格药品的存在,凸显了在药品生产和流通环节中可能存在的质量问题,以及监管体系需要进一步加强和完善的迫切性。相关部门应加强对药品质量的监管力度,确保市场上流通的药品符合安全标准,保障公众用药的安全和有效性。消费者也应提高警惕,选择正规渠道购买药品,避免使用不合格药品带来的健康风险。
本文目录导读:
在2017年,药品质量问题再次成为公众关注的焦点,从国家食品药品监督管理总局(CFDA)到地方食品药品监督管理局,频繁发布的药品质量公告和抽检通告揭示了药品市场中存在的诸多不合格现象,这些不合格药品不仅涉及化学药、抗生素、生化药和中成药,还包括中药材、中药饮片以及医院制剂,严重威胁着患者的用药安全,本文将深入探讨2017年最新不合格药品的情况,分析其原因,并探讨未来的监管方向。
不合格药品概况
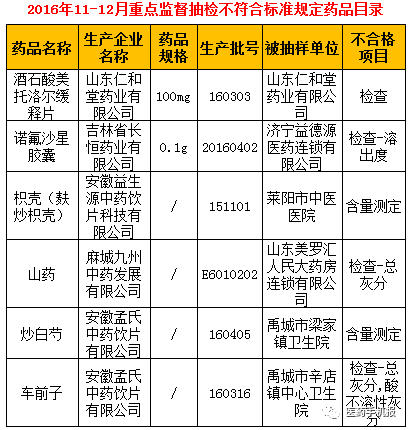
2017年,CFDA及其地方分支机构发布了多份药品抽检通告,揭示了药品市场中不合格药品的严峻形势,据环球健康记者统计,CFDA全年发布了46份药品抽检通告,其中22份涉及中药饮片不合格,19份涉及药品不合格,另外5份为药品包装材料、药用辅料等其他抽检通告,这些不合格药品涵盖了多个知名企业和品牌,包括国药控股、同仁堂、华润医药集团等。
不合格药品案例分析
1、上海市食药监局抽检结果
2017年1月31日,上海市食药监局发布公告,称在对本市药品和药包材生产、经营和使用单位实施的质量监督抽检中,发现27批次不合格药品和2批次不合格药品包装,小儿氨酚黄那敏颗粒等常用儿童药品也被列入不合格名单,这引起了宝妈们的广泛关注,不合格项目包括性状、含量测定、有关物质、炮制、二氧化硫残留等多个方面。
2、江苏省药监局抽检结果
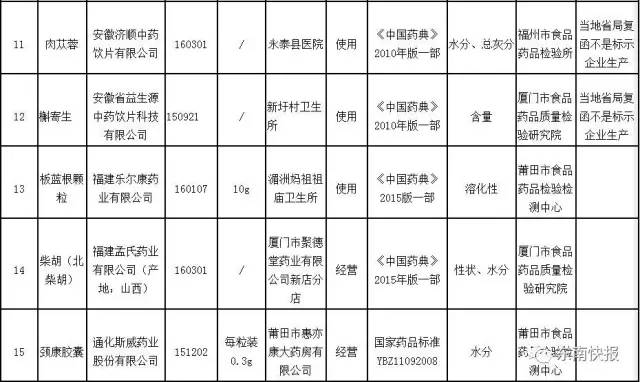
同年12月26日,江苏省药监局发布2017年第4期药品质量公告,将93批次不合格药品予以公告,13批次为化学药、抗生素、生化药、中成药,78批次为中药材、中药饮片,2批次为医院制剂,值得注意的是,有19批次中药材/中药饮片生产企业核查回复不是其生产,这进一步揭示了市场上中药饮片质量控制的复杂性。
3、CFDA通告的不合格药品
2017年,CFDA也发布了多份关于不合格药品的通告,在2017年第10号通告中,CFDA公布了16批次不合格药品名单,涉及山西康威制药有限责任公司、华润三九(临清)药业有限公司等多家知名企业,不合格项目包括性状、含量测定、细菌数、装量差异、溶散时限等多个方面。
不合格药品原因分析
1、生产环节问题
不合格药品的产生往往与生产环节的质量控制不严有关,一些企业为了追求经济效益,忽视了原材料的质量控制和生产过程的规范化管理,导致药品质量不达标,一些企业还存在编造批生产记录、物料管理混乱等问题,进一步加剧了药品质量风险。
2、流通环节问题
在药品流通环节,一些医药流通企业未能对药品质量进行有效评估和控制,导致不合格药品流入市场,特别是对于一些中药材和中药饮片,由于其来源复杂、加工炮制过程繁琐,更容易出现质量问题。
3、监管力度不足
尽管国家不断加强药品质量监管力度,但仍然存在一些监管盲区,一些不法企业和个人利用监管漏洞,以次充好、染色增重、违规炮制等违法行为时有发生。
未来监管方向
1、加强源头治理
要从源头上加强药品质量控制,加强对原材料和生产过程的监管力度,要加大对违法企业的处罚力度,提高违法成本。
2、完善监管体系
要建立健全药品质量监管体系,加强对药品生产、流通和使用环节的监管力度,要加强部门之间的协作和信息共享,形成监管合力。
3、提升公众意识
要加强公众对药品质量的认识和了解,提高公众对不合格药品的警惕性和防范能力,要加强媒体对药品质量问题的监督和报道力度,形成全社会共同关注药品质量的良好氛围。
2017年最新不合格药品的情况再次敲响了药品质量监管的警钟,只有加强源头治理、完善监管体系、提升公众意识等多方面的努力才能有效保障患者的用药安全。


 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号
还没有评论,来说两句吧...